Online Database of Chemicals from Around the World
| 北京翔宇恒天医药技术有限公司 | 中国 | 询价快递 | ||
|---|---|---|---|---|
 |
+86 (10) 5979-9429 8875-5821 | |||
 |
sophia_818@126.com contact@eagleskypharmatech.com | |||
 |
QQ 交谈 | |||
| 化学品生产商 (2009年起) | ||||
| chemBlink 优势供应商 (2010年起) | ||||
| 产品分类 | 生物化工 >> 多肽 |
|---|---|
| 英文名 | Glycyl-L-valyl-L-seryl-L-tryptophylglycyl-L-leucyl-L-arginine |
| 别名 | PE 22-28; (2S)-2-[[(2S)-2-[[2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[(2-aminoacetyl)amino]-3-methylbutanoyl]amino]-3-hydroxypropanoyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]acetyl]amino]-4-methylpentanoyl]amino]-5-(diaminomethylideneamino)pentanoic acid |
| 产品名称 | 甘氨酰-L-缬氨酰-L-丝氨酰-L-色氨酰甘氨酰-L-亮氨酰-L-精氨酸 |
| 分子结构 | 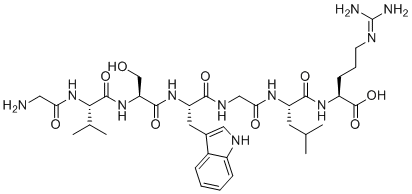 |
| 蛋白质序列 | GVSWGLR |
| 分子式 | C35H55N11O9 |
| 分子量 | 773.88 |
| CAS 登录号 | 1801959-12-5 |
| 分子行输入简码 SMILES |
CC(C)C[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)NC(=O)CNC(=O)[C@H](CC1=CNC2=CC=CC=C21)NC(=O)[C@H](CO)NC(=O)[C@H](C(C)C)NC(=O)CN |
| 密度 | 1.4±0.1 g/cm3 计算值* |
|---|---|
| 折射率 | 1.65 (计算值)* |
| * | 使用计算软件 Advanced Chemistry Development (ACD/Labs). |
|
甘氨酰-L-缬氨酰-L-丝氨酰-L-色氨酰甘氨酰-L-亮氨酰-L-精氨酸是一种短链线性肽,由八个氨基酸残基以特定序列排列组成。这类化合物的出现源于20世纪中期现代肽化学的发展。当时,氨基酸保护策略和偶联反应的进步使得在实验室中制备具有精确序列的肽成为可能。布鲁斯.梅里菲尔德在20世纪60年代初引入固相肽合成法,是实现常规制备此类分子的决定性突破。这种方法使得包含多个残基的肽,包括那些具有庞大或反应性侧链(例如色氨酸和精??氨酸)的肽,能够高效且可重复地合成。像甘氨酰-L-缬氨酰-L-丝氨酰-L-色氨酰甘氨酰-L-亮氨酰-L-精氨酸这样的特定寡肽的合成依赖于这些既定的原理,除非明确指出它是较大蛋白质的一部分,否则它不会自然存在。 因此,这类长度肽的发现与肽合成的整体历史密不可分,而不是源于某种特定天然产物的分离。随着肽化学的成熟,研究人员开始设计和制备短序列肽,以探索氨基酸序列与生物功能之间的关系。合成肽被用作蛋白质区域、酶底物、受体配体或抗原决定簇的简化模型。在单个序列中包含极性残基(如丝氨酸)、疏水残基(如缬氨酸和亮氨酸)、芳香族残基(如色氨酸)和碱性残基(如精氨酸)的能力,使得系统地探索结构-活性关系成为可能。 实际上,甘氨酰-L-缬氨酰-L-丝氨酰-L-色氨酰甘氨酰-L-亮氨酰-L-精氨酸属于一类研究用肽,通常被制备为分析标准品或实验工具。这类肽已用于酶学研究,以研究蛋白酶的特异性,因为可以设计包含潜在切割位点的特定序列,并监测其水解过程。它们也用于受体结合和信号传导研究,其中短肽可以模拟内源性蛋白质的片段,并以可控的方式与生物靶标相互作用。在免疫学研究中,长度相当的合成肽经常被用作抗原,以绘制抗体或T细胞识别的表位,因为它们代表了较大蛋白质的离散且明确的片段。短合成肽的另一个重要应用领域是分析化学和生物化学。这类肽通常用作色谱和质谱分析方法中的校准或参考化合物。其已知的组成和序列有助于验证分析性能、优化分离条件以及确认碎片模式。色氨酸的存在提供了方便的紫外检测发色团,而精氨酸的存在则增强了质谱分析中的电离效率,使得这类肽在方法开发中尤为有用。 近几十年来,人们也开始探索设计寡肽作为生物材料科学和化学生物学中的构建模块。虽然甘氨酰-L-缬氨酰-L-丝氨酰-L-色氨酰甘氨酰-L-亮氨酰-L-精氨酸本身并非商业药物或已确立的治疗剂,但研究人员已对长度和组成相似的肽进行了抗菌活性、细胞穿透特性或作为基于肽的药物递送系统组分方面的研究。这些研究建立在早期肽合成和表征工作所获得的根本理解之上,展示了如何根据特定的实验目的定制合成肽。 总而言之,甘氨酰-L-缬氨酰-L-丝氨酰-L-色氨酰甘氨酰-L-亮氨酰-L-精氨酸的重要性在于它作为一种代表性合成肽,是肽化学进步的产物。它的发现源于方法学的创新,而非天然产物的分离,其应用主要集中在需要明确定义的肽序列来研究生化、分析或生物学问题的研究领域。 参考文献 Merrifield RB (1963) Solid phase peptide synthesis. I. The synthesis of a tetrapeptide. Journal of the American Chemical Society 85 14 2149-2154 DOI: 10.1021/ja00897a025 Fields GB, Noble RL (1990) Solid phase peptide synthesis utilizing 9-fluorenylmethoxycarbonyl amino acids. International Journal of Peptide and Protein Research 35 3 161-214 DOI: 10.1111/j.1399-3011.1990.tb00939.x Srinivasan R, Rose GD (1999) A physical basis for protein secondary structure. Proceedings of the National Academy of Sciences of the United States of America 96 25 14258-14263 DOI: 10.1073/pnas.96.25.14258 |
| 市场分析报告 |
| 请浏览甘氨酰-L-缬氨酰-L-丝氨酰-L-色氨酰甘氨酰-L-亮氨酰-L-精氨酸市场分析报告总目录 |